Asit ve bazlar arasındaki tepkimeler nasıl gerçekleşir?
Kimyasal tepkimelerin temel taşlarından olan asit-baz etkileşimleri, proton ve elektron alışverişi üzerinden gerçekleşir. Arrhenius, Brønsted-Lowry ve Lewis teorileri bu dinamik süreçleri farklı bakış açılarıyla açıklayarak kimyanın günlük hayat ve endüstriyel uygulamalardaki rolünü aydınlatır.
Asit ve Bazlar Arasındaki Tepkimeler Nasıl Gerçekleşir?Asit ve bazlar, kimyasal reaksiyonların temel bileşenleridir ve genellikle proton transferi (H⁺) yoluyla etkileşirler. Bu reaksiyonlar, asit-baz teorilerine göre sınıflandırılabilir. Asidik ve bazik bileşiklerin karşılıklı etkileşimleri, birçok kimyasal işlemde hayati bir rol oynamaktadır. Asit-Baz Teorileri Asit ve bazların etkileşimleri farklı teorilere dayanarak açıklanabilir:
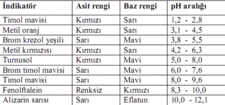
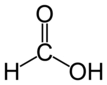
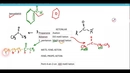
Arrhenius Teorisi Arrhenius teorisine göre, asitler su içerisinde H⁺ iyonu bırakabilen maddelerdir. Örneğin, hidroklorik asit (HCl), su içinde H⁺ ve Cl⁻ iyonlarına dissosye olur. Buna karşın bazlar, su içerisinde OH⁻ iyonu bırakabilen maddelerdir. Örneğin, sodyum hidroksit (NaOH) ise Na⁺ ve OH⁻ iyonlarına ayrışır. Brønsted-Lowry Teorisi Brønsted-Lowry teorisi asitleri proton donorü, bazları ise proton akseptörü olarak tanımlar. Bu tanım sayesinde, asit-baz tepkimeleri, proton alışverişi yoluyla gerçekleşmektedir. Örneğin; HCl + NH₃ → NH₄⁺ + Cl⁻ tepkimesinde, HCl bir proton verebilirken, NH₃ bu protonu kabul etmektedir. Lewis Teorisi Lewis teorisi, asitleri elektron çifti kabul eden, bazları ise elektron çifti veren moleküller olarak tanımlar. Bu tanım, asit-baz tepkimelerini daha geniş bir perspektiften ele almayı mümkün kılar. Örneğin, BF₃ (bor triflorür) bir Lewis asidi olarak davranırken, NH₃ (amonyak) bir Lewis bazıdır ve bu iki molekül arasında güçlü bir etkileşim meydana gelir. Asit-Baz Tepkimeleri Asit ve bazlar arasındaki tepkime, genellikle nötralizasyon tepkimeleri olarak bilinir. Nötralizasyon, bir asidin bir bazla tepkime girmesi sonucu tuz ve su oluşumuna neden olan bir kimyasal reaksiyondur.
Örnek olarak, HCl ve NaOH'in tepkimesi şu şekildedir: HCl(aq) + NaOH(aq) → NaCl(aq) + H₂O(l) Uygulamalar ve Önemi Asit-baz tepkimeleri, endüstriyel alanlarda, laboratuvar uygulamalarında ve günlük yaşantımızda yaygın olarak kullanılmaktadır. Örneğin, bu tepkimeler:
Sonuç Asit ve bazlar arasındaki tepkimeler, hem kimya bilimi açısından hem de günlük yaşamda önemli bir yer tutmaktadır. Bu etkileşimlerin daha iyi anlaşılması, çeşitli uygulamalar için önemli faydalar sağlamakta ve bilimsel ilerlemeyi desteklemektedir. Kimyasal etkileşimlerin temelini oluşturan asit-baz tepkimeleri, ileri düzey bilimsel çalışmalar için mümkün kılmaktadır. |
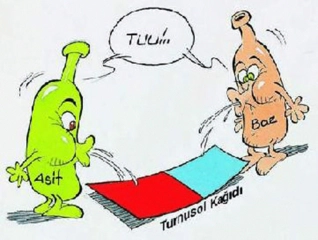








.webp)













.webp)
.webp)