
Tüm asit çözeltilerinde oh iyonu var mı?
Asit çözeltilerinin kimyasal özellikleri ve hidroksit (OH⁻) iyonlarının varlığı üzerine bilgi sunulmaktadır. Asitlerin su içinde çözünmesi, H⁺ iyonlarının artmasına ve dolayısıyla pH değerinin düşmesine neden olurken, suyun doğal disosiyasyonu OH⁻ iyonlarını da içermektedir. Bu durum, asidik ortamlardaki hidroksit iyonlarının konsantrasyonunun düşük olduğunu gösterir.
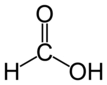
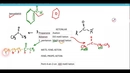
Tüm Asit Çözeltilerinde OH İyonu Var mı?Asit çözeltileri, su içinde asidik özellikler gösteren maddelerin çözündüğü çözeltilerdir. Bu çözeltiler genellikle H⁺ (proton) iyonları salarak pH değerini düşürür. Ancak, asitlerin su içinde çözündüğünde, hidroksit (OH⁻) iyonlarının bulunup bulunmadığı sorusu, kimyasal ve asidik özelliklerin anlaşılması açısından önem taşımaktadır. Asitlerin Kimyasal Yapısı ve Özellikleri Asitler, proton (H⁺) bağışlayabilen maddeler olarak tanımlanmaktadır. Su ile etkileşime girdiklerinde, asitlerin çözünmesi sırasında H⁺ iyonları serbest kalır. Bu durum, asidik bir ortamın oluşmasına neden olur.
OH İyonlarının Varlığı Asit çözeltilerinde OH⁻ iyonlarının varlığı, suyun kendisinden kaynaklanmaktadır. Su, H₂O formülüyle ifade edilir ve bu molekül, H⁺ ve OH⁻ iyonlarına ayrışabilir. Dolayısıyla, her asit çözeltisi, suyun doğal disosiyasyonundan dolayı belirli miktarda hidroksit iyonu içerir.
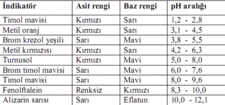
pH ve OH İyonlarının İlişkisi pH, bir çözelti içindeki H⁺ iyonlarının konsantrasyonunu belirten bir ölçüdür. pH değeri ile OH⁻ iyonlarının konsantrasyonu arasında ters bir ilişki bulunmaktadır. pH değeri düştükçe, H⁺ iyonları artmakta ve dolayısıyla OH⁻ iyonlarının konsantrasyonu azalmaktadır.
Sonuç ve Değerlendirme Sonuç olarak, tüm asit çözeltilerinde belirli miktarda OH⁻ iyonu bulunmaktadır. Ancak asidik özellikler, bu iyonların konsantrasyonunun düşüklüğünden kaynaklanmaktadır. Asitlerin su ile etkileşimi, hidrojen iyonlarının varlığını artırırken, hidroksit iyonlarının miktarını azaltmaktadır. Bu durum, asit çözeltilerinin pH değerinin 7'den düşük olmasının nedenidir. Ek Bilgiler Asitlerin çeşitli türleri bulunmakta olup, bunlar arasında sülfürik asit (H₂SO₄), hidroklorik asit (HCl) ve nitrik asit (HNO₃) gibi güçlü asitler yer almaktadır. Güçlü asitler, tamamen iyonlaşarak H⁺ iyonları salarken, zayıf asitler kısmi iyonlaşma gösterir.
Bu bilgiler, asit çözeltilerinin kimyasal doğasının anlaşılmasına katkıda bulunmakta ve OH⁻ iyonlarının varlığının önemini vurgulamaktadır. |








.webp)













.webp)
.webp)

Asit çözeltilerinde OH iyonlarının varlığı gerçekten merak uyandıran bir konu. Asitlerin su ile etkileşimi sonucunda hidrojen iyonlarının serbest kalmasıyla asidik bir ortam oluştuğunu biliyoruz. Peki, bu durumda suyun doğal disosiyasyonundan dolayı belirli miktarda hidroksit iyonlarının da bulunması durumu nasıl etkiliyor? Asidik bir ortamda OH iyonlarının konsantrasyonunun azalması, aslında asitlerin özelliklerini anlamamızda ne gibi katkılar sağlıyor? Ayrıca, pH ve OH iyonları arasındaki ilişkiyi düşündüğümüzde, pH değeri düştükçe OH iyonlarının azalması, asidik özelliklerin daha da belirginleşmesine mi yol açıyor? Bu noktada, asitlerin çeşitliliği ve güçlü-zayıf asitler arasındaki farklar da önemli bir etken. Bu konuyu daha derinlemesine incelemek, asitlerin kimyasal doğasını anlamak için faydalı olabilir.
Acarsoy,
Asitlerin Su ile Etkileşimi
Asitlerin su ile etkileşimi sonucunda hidrojen iyonlarının serbest kalmasıyla asidik bir ortam oluştuğu doğru. Bu süreç, asitlerin su içinde dissosiyasyon göstererek H⁺ iyonları bırakması ile gerçekleşir. Ancak bu durumda suyun doğal dissosiyasyonu sonucu oluşan OH⁻ iyonlarının varlığı da önemli bir etken. Su, kendi içinde de H⁺ ve OH⁻ iyonlarına ayrışabildiği için, asidik ortamlarda OH⁻ iyonlarının konsantrasyonu azalır.
OH İyonlarının Konsantrasyonu ve Asidik Ortam
Asidik bir ortamda OH⁻ iyonlarının azalması, aslında asitlerin özelliklerini anlamamızda çok önemli bir katkı sağlar. OH⁻ konsantrasyonu düşük olduğunda, pH değeri düşer ve bu durum asidik özelliklerin daha belirgin hale gelmesine yol açar. Yani, pH değeri düştükçe, asidik özellikler artar.
pH ve OH İyonları Arasındaki İlişki
pH ve OH⁻ iyonları arasındaki ilişki, asit-baz kimyasının temelini oluşturur. pH değeri düştüğünde, OH⁻ iyonlarının konsantrasyonu azalır ve bu durum asidik özelliklerin daha da belirginleşmesine katkı sağlar. Dolayısıyla, pH değerinin düşmesi, asidin gücünü ve özelliklerini anlamak için önemli bir gösterge olur.
Asitlerin Çeşitliliği
Asitlerin çeşitliliği ve güçlü-zayıf asitler arasındaki farklar da bu anlayış açısından kritik öneme sahiptir. Güçlü asitler, su ile etkileşimde daha fazla H⁺ iyonu serbest bıraktığı için daha belirgin asidik özellikler gösterir. Zayıf asitler ise daha az H⁺ iyonu saldığı için, pH değerleri daha az düşer ve asidik özellikleri daha az belirgindir. Bu nedenle, asitlerin kimyasal doğasını anlamak için bu farklılıkları incelemek oldukça faydalıdır.