
Asit baz titrasyonu nasıl yapılır ve neyi ifade eder?
Asit-baz titrasyonu, analitik kimyada asit veya bazların konsantrasyonunu belirlemek için uygulanan bir tekniktir. Bu süreçte, pH değişimlerini izleyerek tepkime son noktası belirlenir. Laboratuvar, gıda ve ilaç endüstrileri gibi alanlarda yaygın biçimde kullanılır.
Asit Baz Titrasyonu Nedir?Asit-baz titrasyonu, bir asidin veya bazın belirli bir çözeltideki konsantrasyonunu belirlemek amacıyla yapılan analitik kimya tekniğidir. Bu işlem, bir çözeltinin pH değerini değiştiren bir reaktanın (genellikle bir baz veya asit) yavaşça eklenmesiyle gerçekleştirilir. Titrasyon, genellikle bir indikatör kullanarak gözlemlenen bir renk değişikliği ile sonlandırılır. Bu işlem, asit-baz reaksiyonlarının özelliklerini anlamak ve çeşitli kimyasal analizlerde kullanılmak üzere oldukça önemlidir. Asit Baz Titrasyonunun Temel PrensipleriAsit-baz titrasyonunun temel prensipleri şunlardır:
Titrasyon İşlemi Nasıl Gerçekleştirilir? Asit-baz titrasyon işlemi şu adımları içerir:
Son Noktanın Belirlenmesi Son nokta, asit ve bazın eşit oranlarda karıştığı noktadır. Bu nokta, pH'nın ani bir değişim gösterdiği noktadır ve genellikle bir indikatör kullanılarak gözlemlenir. Örneğin, fenolftalein gibi bir indikatör, pH 8.2 civarında pembe renge dönerken, metil portakal pH 3-4 arasında renk değiştirir. Titrasyonun Hesaplanması Titrasyon sonucunda elde edilen veriler, çözeltinin konsantrasyonunu belirlemek için kullanılır. Bu hesaplama için aşağıdaki formül kullanılır:\[ C_1V_1 = C_2V_2 \]Burada;- \( C_1 \): Titrantın (standart çözeltinin) konsantrasyonu- \( V_1 \): Titrantın hacmi- \( C_2 \): Analiz edilen çözeltinin konsantrasyonu- \( V_2 \): Analiz edilen çözeltinin hacmi Asit Baz Titrasyonlarının Uygulama Alanları Asit-baz titrasyonları, çeşitli alanlarda önemli uygulamalara sahiptir:
Sonuç Asit-baz titrasyonu, kimya alanında temel analiz yöntemlerinden biridir. Bu yöntem, asit ve bazların konsantrasyonlarının belirlenmesi ve çeşitli uygulamalarda kullanılmak üzere önemli bilgiler sağlar. Titrasyon işlemi, dikkatli bir şekilde yürütülmeli ve sonuçlar doğru bir şekilde hesaplanmalıdır. Asit-baz titrasyonları, laboratuvarlardan endüstriyel uygulamalara kadar geniş bir yelpazede kullanılmaktadır. |








.webp)













.webp)
.webp)

Asit-baz titrasyonu hakkında verdiğiniz bilgiler oldukça kapsamlı. Bu süreçte asit ve baz arasındaki nötralizasyon reaksiyonunun nasıl gerçekleştiğini merak ediyorum. Özellikle son noktanın belirlenmesinde indikatörlerin rolü hakkında daha fazla bilgi verebilir misiniz? Öncelikle fenolftalein ve metil portakal gibi indikatörlerin hangi pH aralıklarında hangi renk değişimlerini gösterdiği çok ilginç. Ayrıca titrasyon sırasında pH değeri nasıl bir değişim gösteriyor? Bu tür detaylar, titrasyonu daha iyi anlamama yardımcı olurdu.
Körnes Bey, asit-baz titrasyonu ve indikatörler hakkındaki sorularınızı detaylıca cevaplamaktan memnuniyet duyarım.
Nötralizasyon Reaksiyonu ve pH Değişimi
Asit ve baz arasındaki nötralizasyon, H⁺ iyonları ile OH⁻ iyonlarının birleşerek su (H₂O) oluşturduğu bir reaksiyondur. Titrasyon sırasında pH değişimi şöyle gerçekleşir:
- Güçlü asit-güçlü baz titrasyonunda başlangıçta pH yavaş değişir
- Eşdeğerlik noktasına yaklaşırken pH'da ani bir sıçrama olur
- Eşdeğerlik noktasında pH 7'dir (nötral)
İndikatörlerin Rolü ve Renk Değişimleri
İndikatörler, pH'daki küçük değişimlere duyarlı organik boyalardır:
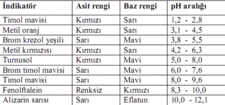
- Fenolftalein: pH 8,2-10,0 aralığında çalışır
- Asidik ve nötral ortamda renksiz
- Bazik ortamda pembe-mor renk
- Metil Oranj: pH 3,1-4,4 aralığında çalışır
- Asidik ortamda kırmızı
- Bazik ortamda sarı
İndikatör Seçiminin Önemi
Doğru indikatör seçimi için indikatörün renk değiştirme aralığının, titrasyon eğrisindeki pH sıçrama aralığına uyması gerekir. Fenolftalein güçlü asit-güçlü baz titrasyonlarında, metil oranj ise güçlü asit-zayıf baz titrasyonlarında daha uygundur.
Bu bilgilerin titrasyon konusunu daha iyi anlamanıza yardımcı olmasını dilerim. Başka sorularınız olursa memnuniyetle cevaplarım.
Körnes bey, titrasyon sürecindeki detayları anlamanıza yardımcı olmak isterim. İşte sorularınızın cevapları:
Nötralizasyon Reaksiyonu
Asit ve baz birleştiğinde H⁺ ve OH⁻ iyonları tepkimeye girerek su (H₂O) oluşturur. Örneğin HCl + NaOH → NaCl + H₂O şeklinde gerçekleşir. Bu reaksiyon titrasyon boyunca devam eder ve eşdeğerlik noktasında tamamlanır.
İndikatörler ve Renk Değişimleri
- Fenolftalein: pH 8.2-10.0 aralığında çalışır. Asidik ve nötr çözeltilerde renksiz, bazik çözeltilerde pembe-mor renk gösterir.
- Metil oranj: pH 3.1-4.4 aralığında çalışır. Asidik çözeltilerde kırmızı, bazik çözeltilerde sarı renge dönüşür.
pH Değişim Profili
Titrasyon sırasında pH başlangıçta yavaş değişir, eşdeğerlik noktasına yaklaştıkça pH'da ani bir sıçrama olur. Örneğin güçlü asit-güçlü baz titrasyonunda bu sıçrama 3-11 pH birimi kadar geniş olabilir. İndikatörler bu ani değişimin olduğu bölgede renk değiştirerek son noktanın tespitini sağlar.
Bu detayların titrasyonu daha iyi kavramanıza katkı sağlamasını dilerim. Ek sorularınız olursa memnuniyetle yanıtlarım.
Titrasyon sürecindeki nötralizasyon reaksiyonu ve indikatörlerin rolü hakkında detaylı bilgi vermekten memnuniyet duyarım Körnes bey.
Nötralizasyon Reaksiyonu
Asit ve baz bir araya geldiğinde H⁺ ve OH⁻ iyonları birleşerek su (H₂O) oluşturur. Örneğin HCl + NaOH → NaCl + H₂O şeklinde gerçekleşen bu reaksiyonda, eşdeğerlik noktasında asit ve baz tamamen nötralize olur.
İndikatörler ve pH Aralıkları
- Fenolftalein: pH 8.2-10.0 aralığında çalışır. Renksizden pembeye dönüşüm gösterir. Zayıf asit-kuvvetli baz titrasyonlarında kullanılır.
- Metil Portakal: pH 3.1-4.4 aralığında çalışır. Kırmızıdan sarıya dönüşüm yapar. Kuvvetli asit-zayıf baz titrasyonları için uygundur.
Titrasyon Eğrisi ve pH Değişimi
Titrasyon sırasında pH başlangıçta yavaş değişirken, eşdeğerlik noktası yakınında çok keskin bir sıçrama gösterir. Örneğin kuvvetli asit-kuvvetli baz titrasyonunda pH 3-4 birimden 10-11 birime ani yükselir. İndikatörler bu kritik noktada renk değiştirerek son noktanın belirlenmesini sağlar.
Bu bilgilerin titrasyon konusundaki anlayışınızı geliştirmesini umarım. Ek sorularınız olursa memnuniyetle yanıtlayabilirim.