
Asitler Ve Bazlar İndikatörlerle Nasıl Tanınır?
Asitler ve bazlar, kimya alanında önemli kavramlardır. Bu yazıda, asit ve bazların tanımını, indikatörlerin bu maddeleri tanımlamadaki rolünü ve çeşitli indikatör türlerini keşfedeceksiniz. Ayrıca indikatörlerin kullanım alanları hakkında bilgi verilecektir.
Asitler ve Bazlar İndikatörlerle Nasıl Tanınır?Asitler ve bazlar, kimya biliminde önemli bir yere sahip olan iki temel madde grubudur. Bu maddelerin tanınmasında kullanılan indikatörler, asit ve bazların özelliklerini belirlemede kritik bir rol oynar. Bu makalede, asitler ve bazlar hakkında genel bilgiler verilecek, indikatörlerin işlevleri açıklanacak ve çeşitli indikatör türleri üzerinde durulacaktır. Asitler ve Bazlar Nedir?Asitler, sulu çözeltilerinde hidrojen iyonu (H⁺) salan maddelerdir. Bu özellikleri nedeniyle asidik bir pH değerine sahiptirler. Genel olarak, asitlerin pH değeri 0 ile 7 arasında değişmektedir. Örnek olarak, hidroklorik asit (HCl), sülfürik asit (H₂SO₄) ve nitrik asit (HNO₃) gibi maddeler asitlerdir. Bazlar ise, sulu çözeltilerinde hidroksit iyonu (OH⁻) salan maddelerdir ve bu nedenle bazik bir pH değerine sahiptirler. Bazların pH değeri 7 ile 14 arasında değişmektedir. Örnek olarak, sodyum hidroksit (NaOH), potasyum hidroksit (KOH) ve kalsiyum hidroksit (Ca(OH)₂) gibi maddeler bazlardır. İndikatörlerin Rolü İndikatörler, asit veya bazın varlığını belirlemek için kullanılan kimyasal maddelerdir. Bu maddeler, pH seviyesine bağlı olarak renk değiştirirler. İndikatörler, asit-baz tepkimeleri ve pH analizlerinde yaygın olarak kullanılmaktadır. İndikatörlerin başlıca işlevleri şunlardır:
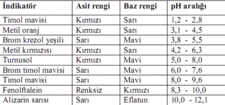
Çeşitli İndikatör Türleri Farklı pH aralıklarına duyarlı olan çeşitli indikatörler mevcuttur. Bunlar arasında en yaygın olanları şunlardır:
İndikatörlerin Kullanım Alanları İndikatörler, birçok farklı alanda kullanılmaktadır. Bunlar arasında:
Sonuç Asitler ve bazlar, kimya biliminde temel kavramlardır ve indikatörler, bu maddelerin tanınmasında ve pH seviyelerinin belirlenmesinde önemli bir rol oynar. Farklı indikatör türleri, çeşitli pH aralıklarında renk değiştirerek, asit ve bazların varlığını kolayca tespit etmemizi sağlar. Bu nedenle, indikatörlerin kullanımı, bilimsel araştırmalardan eğitim süreçlerine kadar geniş bir yelpazede önem taşımaktadır. |








.webp)













.webp)
.webp)

Asitler ve bazlar hakkında verdiğiniz bilgiler oldukça kapsamlı. Özellikle indikatörlerin rolü ve çeşitleri hakkında yapılan açıklamalar çok faydalı. Asitlerin ve bazların tanımlanması için indikatörlerin nasıl kullanıldığına dair örnekler vermeniz, konunun daha iyi anlaşılmasını sağlıyor. Peki, fenolftalein ve metil oranj gibi indikatörlerin farklı pH aralıklarındaki renk değişimlerini gözlemlemek için hangi deneyleri yapmayı önerirsiniz?
Barlas,
Deney Önerileri
Fenolftalein ve metil oranj gibi indikatörlerin pH aralıklarındaki renk değişimlerini gözlemlemek için birkaç farklı deney yapabilirsiniz.
1. pH Çözeltileri Hazırlama: Farklı pH değerlerine sahip çözeltiler hazırlamak için asidik ve bazik maddeler kullanabilirsiniz. Örneğin, sirke (asit) ve sabun (baz) ile birlikte su kullanarak 3, 7 ve 10 pH değerlerine sahip çözeltiler oluşturabilirsiniz.
2. İndikatör Eklemek: Hazırladığınız çözeltilere fenolftalein ve metil oranj indikatörlerini ekleyin. Her iki indikatör de farklı pH aralıklarında farklı renkler gösterecektir. Fenolftalein, pH 8.2'nin üzerinde pembe renk verirken, metil oranj pH 3.1'in altında kırmızı, 4.4'te turuncu ve 6.0'da sarı renk alır.
3. Gözlem Yapmak: Her bir çözeltideki renk değişimini gözlemleyin ve not alın. Farklı pH değerlerindeki renk değişimlerini karşılaştırarak indikatörlerin pH ile nasıl bir etkileşimde bulunduğunu daha iyi anlayabilirsiniz.
Sonuçların Analizi
Deneylerin sonunda, her indikatörün hangi pH aralıklarında hangi renkleri gösterdiğini analiz ederek, asit ve bazların tanımlanmasında indikatörlerin önemini pekiştirebilirsiniz. Bu tür deneyler, teorik bilgiyi pratiğe dökerek konunun daha iyi anlaşılmasını sağlar.
Umarım bu öneriler faydalı olur!